Fala, Cabeç@s!
Ah!: deixem comentários com seus nomes no final dessa página para eu saber quem está frequentando esse blog, valeu!
MASSA ATÔMICA (A MASSA DO ÁTOMO)
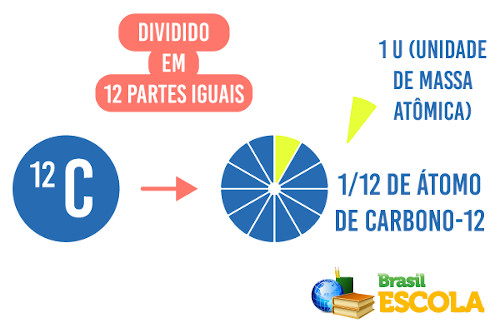
A massa atômica é a massa de um átomo ou de um elemento químico em relação a 1/12 da massa de um átomo de carbono-12.
Exemplo de aplicação e interpretação da massa atômica
Se afirmarmos que a massa atômica de um átomo do elemento sódio (Na) é igual a 23 u, queremos dizer que 1 átomo de sódio é 23 vezes maior que a massa de 1/12 da massa do carbono-12.
MOL, MASSA MOLECULAR E NÚMERO DE AVOGADRO
Mol é uma unidade de medida utilizada para expressar a quantidade de matéria microscópica, como átomos e moléculas. É um termo que provém do latim mole, que significa quantidade, e foi proposto pela primeira vez em 1896 pelo químico Wilhem Ostwald. Porém, foi Amedeo Avogadro que sugeriu, em 1811, que a mesma quantidade de matérias diferentes apresentaria a mesma quantidade de moléculas, o que foi chamado de Constante de Avogadro.
6,02.1023 entidades (átomos, moléculas, como elétrons, prótons e nêutron)
Massa molecular (MM) x Massa molar (M)
- Massa molecular (MM)
É a soma das massas atômicas de cada átomo que forma a respectiva molécula.
Qual seria a massa molecular do gás Sulfídrico (H2S), por exemplo?
Primeiro é preciso saber qual é a massa atômica de cada átomo, que é dada pela Tabela Periódica dos elementos, assim:
- Massa atômica do hidrogênio (H) = 1u
- Massa atômica do enxofre (S) = 32,1u
Massa molecular do H2S = 1 x 2 + 32,1 = 34,1 u
- Massa molar (M)
Massa molar é a massa em gramas (g) presente em 6,02.1023 entidades elementares, ou seja, é o número que corresponde a um mol. Seu valor é o mesmo que o da massa molecular, mas a sua unidade é dada em g/mol .Assim utilizando ainda o exemplo do gás Sulfídrico (H2S):
- Massa Molecular = 34,1 u
- Massa molar (M) = 34,1 g/mol
Isso quer dizer que, em 34,1 g/mol de gás sulfídrico, temos 6,02 x 1023 moléculas ou 1 mol de moléculas de gás sulfídrico.
Mapa Mental - Mol
Seguem abaixo uns vídeos para reforçar o entendimento:
Vídeo 1 - O que é o Mol
Vídeo 2 - como calcular a massa molecular
Vídeo 3 - como calcular a massa molar
Vídeo 4 - Como calcular o número de mols
Exercícios I
1. As medidas de massa são, na realidade, a
comparação com um padrão definido de maneira adequada. O padrão adotado para as
medidas de massa atômica é 1/12 da massa do carbono - 12, que é
denominado de unidade de massa atômica (u).
Sobre massas de átomos, coloque V
para verdadeiro e F para falso nas
afirmativas abaixo:
a) os átomos de um mesmo elemento químico
podem ter massas diferentes; ( )
b) massa atômica indica quantas vezes a
massa de um átomo é maior que 1/12 do carbono -12; ( )
c) as massas atômicas são utilizadas
atualmente para classificar os elementos da Tabela Periódica. ( )
2. Observe as afirmações a seguir e depois
indique quais estão corretas:
I. A unidade de massa
atômica pode ser representada por m;
II. A unidade de
massa atômica é 1/12 da massa do átomo de carbono de número de massa igual a
12;
III. A unidade de
massa atômica é 1/12 da massa de um átomo de carbono;
IV. A massa atômica
de um átomo é um número muito próximo de seu número de massa.
(a) Todas.
(b) Nenhuma.
(c) Somente II e IV.
(d) Somente I, II e IV.
(e) Somente I, III e IV.
3. Se um átomo apresentar a massa atômica
igual a 48 u, a relação entre a massa desse átomo e a massa do átomo de carbono-12
valerá? (Faça os cálculos e marque a alternativa correta)
(a) 1
(b) 2
(c) 3
(d) 4
(e) 5
4. Assinale a alternativa que indica,
respectivamente, as massas moleculares corretas das seguintes substâncias: H2SO4 e H4P2O7. (Faça os cálculos e marque a alternativa correta)
(Massas atômicas: H = 1; N = 14; O = 16, P = 31; S = 32).
(a) 97 u, 178 u
(b) 98 u, 179 u
(c) 98 u, 178 u
(d) 96 u, 174 u
(e) 98 u, 188 u
Enviar a foto das respostas no caderno para o meu e-mail: ednei.merces@enova.educacao.ba.gov.br
Mais exercícios Família!!
Exercícios II
Enviar a foto das respostas no caderno para o meu e-mail: ednei.merces@enova.educacao.ba.gov.br
Valeu!!
Prof. Ednei