Fala, Cabeç@s!
Ah!: deixem comentários com seus nomes no final dessa página para eu saber quem está frequentando esse blog, valeu!
MASSA ATÔMICA (A MASSA DO ÁTOMO)
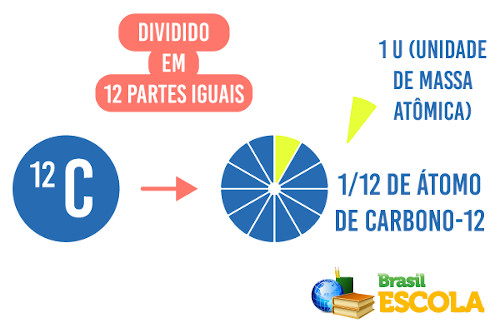
A massa atômica é a massa de um átomo ou de um elemento químico em relação a 1/12 da massa de um átomo de carbono-12.
Exemplo de aplicação e interpretação da massa atômica
Se afirmarmos que a massa atômica de um átomo do elemento sódio (Na) é igual a 23 u, queremos dizer que 1 átomo de sódio é 23 vezes maior que a massa de 1/12 da massa do carbono-12.
MOL, MASSA MOLECULAR E NÚMERO DE AVOGADRO
Mol é uma unidade de medida utilizada para expressar a quantidade de matéria microscópica, como átomos e moléculas. É um termo que provém do latim mole, que significa quantidade, e foi proposto pela primeira vez em 1896 pelo químico Wilhem Ostwald. Porém, foi Amedeo Avogadro que sugeriu, em 1811, que a mesma quantidade de matérias diferentes apresentaria a mesma quantidade de moléculas, o que foi chamado de Constante de Avogadro.
6,02.1023 entidades (átomos, moléculas, como elétrons, prótons e nêutron)
Massa molecular (MM) x Massa molar (M)
- Massa molecular (MM)
É a soma das massas atômicas de cada átomo que forma a respectiva molécula.
Qual seria a massa molecular do gás Sulfídrico (H2S), por exemplo?
Primeiro é preciso saber qual é a massa atômica de cada átomo, que é dada pela Tabela Periódica dos elementos, assim:
- Massa atômica do hidrogênio (H) = 1u
- Massa atômica do enxofre (S) = 32,1u
Massa molecular do H2S = 1 x 2 + 32,1 = 34,1 u
- Massa molar (M)
Massa molar é a massa em gramas (g) presente em 6,02.1023 entidades elementares, ou seja, é o número que corresponde a um mol. Seu valor é o mesmo que o da massa molecular, mas a sua unidade é dada em g/mol .Assim utilizando ainda o exemplo do gás Sulfídrico (H2S):
- Massa Molecular = 34,1 u
- Massa molar (M) = 34,1 g/mol
Isso quer dizer que, em 34,1 g/mol de gás sulfídrico, temos 6,02 x 1023 moléculas ou 1 mol de moléculas de gás sulfídrico.
Mapa Mental - Mol
Seguem abaixo uns vídeos para reforçar o entendimento:
Vídeo 1 - O que é o Mol
Vídeo 2 - como calcular a massa molecular
Vídeo 3 - como calcular a massa molar
Vídeo 4 - Como calcular o número de mols
Exercícios I
1. As medidas de massa são, na realidade, a
comparação com um padrão definido de maneira adequada. O padrão adotado para as
medidas de massa atômica é 1/12 da massa do carbono - 12, que é
denominado de unidade de massa atômica (u).
Sobre massas de átomos, coloque V
para verdadeiro e F para falso nas
afirmativas abaixo:
a) os átomos de um mesmo elemento químico
podem ter massas diferentes; ( )
b) massa atômica indica quantas vezes a
massa de um átomo é maior que 1/12 do carbono -12; ( )
c) as massas atômicas são utilizadas
atualmente para classificar os elementos da Tabela Periódica. ( )
2. Observe as afirmações a seguir e depois
indique quais estão corretas:
I. A unidade de massa
atômica pode ser representada por m;
II. A unidade de
massa atômica é 1/12 da massa do átomo de carbono de número de massa igual a
12;
III. A unidade de
massa atômica é 1/12 da massa de um átomo de carbono;
IV. A massa atômica
de um átomo é um número muito próximo de seu número de massa.
(a) Todas.
(b) Nenhuma.
(c) Somente II e IV.
(d) Somente I, II e IV.
(e) Somente I, III e IV.
3. Se um átomo apresentar a massa atômica
igual a 48 u, a relação entre a massa desse átomo e a massa do átomo de carbono-12
valerá? (Faça os cálculos e marque a alternativa correta)
(a) 1
(b) 2
(c) 3
(d) 4
(e) 5
4. Assinale a alternativa que indica,
respectivamente, as massas moleculares corretas das seguintes substâncias: H2SO4 e H4P2O7. (Faça os cálculos e marque a alternativa correta)
(Massas atômicas: H = 1; N = 14; O = 16, P = 31; S = 32).
(a) 97 u, 178 u
(b) 98 u, 179 u
(c) 98 u, 178 u
(d) 96 u, 174 u
(e) 98 u, 188 u
Enviar a foto das respostas no caderno para o meu e-mail: ednei.merces@enova.educacao.ba.gov.br
Mais exercícios Família!!
Exercícios II
Enviar a foto das respostas no caderno para o meu e-mail: ednei.merces@enova.educacao.ba.gov.br
Valeu!!
Prof. Ednei



Gostei muito da explicação , bem formulada... Thaiane Paixão
ResponderExcluirAchei legal... Anivalda conceição
ResponderExcluirTá batendo Edney das cobras: Victor lobo
ResponderExcluirTá manteiga, gosteii!! Nalanda Santos
ResponderExcluirGostei!Luana Barbosa
ResponderExcluirIcaro Santos
ResponderExcluirGostei das explicações!!! Naila Souza
ResponderExcluirGostei lais souza
ResponderExcluirTá ótimo,
ResponderExcluirLuana.bento@aluno.enova.educacao.ba.gov.br
ResponderExcluirICARO VITÓRIO DOS SANTOS PEREIRA
ResponderExcluiranivalda.santos@aluno.enova.educacao.ba.gov.br
ResponderExcluirJoseane de jesus ótimo assunto
ResponderExcluirJamile pereira de souza ,👏🏼👏🏼👏🏼
ResponderExcluirEdelzuita Lima
ResponderExcluirjeseane.pereira@aluno.enova.educacao.ba.gov.br
ResponderExcluirGostei muito da explicação
ResponderExcluirLorena Sena Barbosa
Bruna Barbosa da paixão
ResponderExcluirsamuel.santiago1@aluno.enova.educacao.ba.gov.br
ResponderExcluirbruna.paixao16@aluno.enova.educacao.ba.gov.br
ResponderExcluirnaila.souza6@aluno.enova.educacao.ba.gov.br
ResponderExcluirGabriel dos Santos Costa Dias
ResponderExcluirgabriel.dias63@aluno.enova.educacao.ba.gov.br
ResponderExcluirNalanda presente : nalanda.santana1@aluno.enova.educacao.ba.gov.br
ResponderExcluirmaria.santos4517@aluno.enova.educacao.ba.gov.br
ResponderExcluirAssunto top de mais
ResponderExcluirMaria Vitorya Silva dos Santos
ResponderExcluirthaiane.paixao1@aluno.enova.educacao.ba.gov.br
ResponderExcluirTHAIANE SOUZA DA PAIXÃO
Lorena Sena @larena.barbosa@aluno.enova.educacao.ba.gov.br
ResponderExcluirAnivalda Conceição
ResponderExcluirWillian.oliveira70@aluno.enova.educacao.ba.gov.br
ResponderExcluirNatalhatexeiradejesus@gmail.com
ResponderExcluirMuito bom
ResponderExcluirPOLIANA BARBOSA DOS Santos
Massah fera🐊❤️
ResponderExcluirRafael Silva Queiroz
ResponderExcluirVanessa Sena de Jesus
ResponderExcluirErica Brandão Nery
ResponderExcluirMarivania santos Neri
ResponderExcluirJosé Carlos da c. neri
ResponderExcluirMassa
ResponderExcluirMikaelle virgens
ResponderExcluirCamila Barbosa da paixao
ResponderExcluirDaiane Almeida Teixeira
ResponderExcluirPaulo Henrique Jesus de Souza
ResponderExcluir